专题研究专栏
编者按:发酵过程中微生物代谢转化的作用本质决定了菌种是保证发酵食品品质和安全的关键。菌群结构解析、酿造菌株筛选、产酶解毒机理等一直是食品微生物领域研究热点,相关内容可为进一步研究传统发酵食品特征保持、品质提升、安全保证、资源利用等奠定基础。本期两篇文章,其一对四川麸醋曲药中产酯酵母进行分离鉴定并对其发酵特性进行研究,传统食醋酿造微生物的解析可对进一步推进食醋工业化和标准化生产提供参考;其二玉米赤霉烯酮降解酶ZHD795编码基因的克隆及降解活性研究,可为陈化粮资源综合利用提供切实帮助,将对食品工业绿色化和可持续发展产生积极影响。
(主持人:廖永红教授)
毛 祥1,2, 夏 玙1, 张芸曌1, 朱 敏1, 张 曼1, 黄 丹1, 罗惠波1,2,*
(1.四川理工学院 生物工程学院, 四川 自贡 643000;2.四川省川南晒制麸醋生物酿造技术工程实验室, 四川 自贡 643000)
摘 要:通过平皿生化反应从四川麸醋曲药中分离出产酯能力较强的酵母菌,利用18S rDNA同源序列分析对其进行鉴定,研究其最适生长pH值、酒精耐受性、碳源和氮源同化能力,并利用顶空固相微萃取- 气质联用技术对其代谢产物进行研究。结果表明:产酯透明圈实验分离出的产酯能力较强的酵母菌为异常威克汉姆酵母菌亚种(Wicherhamomycessp. Lzcq 2014)。该株酵母菌的最适合生长pH值为5.0~5.5,在酒精度为10%的情况下几乎不生长;对不同碳源同化能力强弱顺序依次是葡萄糖、蔗糖、麦芽糖、乳糖、淀粉;对不同氮源同化能力强弱顺序依次是酵母膏、蛋白胨、硫酸铵、尿素。该酵母菌代谢产物主要成分为乙酸乙酯,其质量浓度为0.640 79 mg/L,且乙酸乙酯浓度远高于其他代谢产物。其他代谢产物分别为甲酸异戊酯、丙酸苯乙酯、苯乙醇,质量浓度分别为0.041 36、0.039 43、0.023 00 mg/L。
关键词:麸醋曲药; 酵母菌; 生长特性; 发酵特性; 挥发性成分
中图分类号:TS264.2; TS201.3
文献标志码:A
![]()
doi:10.3969/j.issn.2095-6002.2018.06.004
文章编号:2095-6002(2018)06-0021-07
引用格式:毛祥,夏玙,张芸曌,等. 四川麸醋曲药中酵母菌的分离鉴定及发酵特性[J]. 食品科学技术学报,2018,36(6):21-27.
MAO Xiang, XIA Yu,ZHANG Yunzhao, et al. Isolation, identification and fermentation characteristics of yeast from Sichuan bran vinegar starter[J]. Journal of Food Science and Technology, 2018,36(6):21-27.
收稿日期:2018-10-20
基金项目:固态酿造关键技术研究四川省院士(专家)工作站资助项目(DY2015-02); 四川省经信委企业技术创新专项(2015XM080); 肉类加工四川省重点实验室资助项目(17-F- 02)。
作者简介:
毛 祥,男,硕士研究生,研究方向为固态酿造功能微生物;
*罗惠波,男,教授,主要从事固态酿造生物技术及应用方面的研究,通信作者。
四川麸醋是中国四大名醋之一,具有色泽红棕、醇香回甜、酸味柔和、久陈不腐的特点[1-2]。以麸皮为制醋原料,通过糖化、酒精发酵、醋酸发酵等工艺自然开发式生产,属于传统固态发酵[3]。
关于四川麸醋的研究多关注于发酵过程微生物、风味物质的动态变化及某一功能菌的筛选[4]。如刘军等[1]分析了保宁醋固态发酵过程中理化指标含量的变化,彭杨等[2]对其固态发酵过程中真菌和细菌的多样性进行分析;于华等[5]从醋醅中筛选出一株产酸能力强的芽孢杆菌,并对其产酸特性进行研究。目前针对四川麸醋发酵过程中微生物菌群、品质形成机理与调控、风味物质构成及保持等研究较少。
曲药是麸醋酿造的发酵启动剂,能提供丰富的菌系和酶系,为液化、糖化、酒化、发酵生香提供动力[6]。曲药微生物经过长期驯化,其种类不断丰富,其中产酯酵母也存在于曲药中,对醋的风味形成起到重要作用[7],但有关曲药中微生物的研究鲜有报道。本研究从四川某麸醋厂提供的曲药中分离筛选出一株产酯酵母菌,并对其生长特性和发酵代谢产物进行研究,旨在为提高麸醋的质量和增加其风味提供依据。
麸醋曲药,四川某麸醋厂;大米、麸皮,市售;牛肉膏、蛋白胨、酵母膏、琼脂麦芽糖、可溶性淀粉、糖化酶、中性蛋白酶、乳糖、葡萄糖,均为生化试剂,成都市科龙化工试剂厂;氯化钠、尿素、KH2PO4、氢氧化钠、脱氧胆酸钠、氯仿,均为分析纯,成都市科龙化工试剂厂;三丁酸甘油酯,色谱纯,四川都康生物科技有限公司。YPD培养基、产酯平板筛选培养基:YPD培养基加0.4%三丁酸甘油酯、虎红琼脂培养基、马铃薯葡萄糖培养基、无碳源基础培养基[8]、无氮源基础培养基[8];50/30 μm DVB/CAR on PDMS萃取头,上海安谱实验科技股份有限公司。
BH200型生物显微镜,宁波舜宇仪器有限公司;STARTER2C型pH计,福建省泉州市高科杰实验仪器设备有限公司;250HL型恒温培养箱,金坛市岸头中旺实验仪器厂;YX- 24LDJ型手提式压力蒸汽灭菌锅,河南兄弟仪器设备有限公司;TD- 5Z型台式低速多管架离心机,北京亿达科创科技有限公司;可见分光光度计,上海仪电分析仪器厂;S1000TM型PCR仪,北京博雅创新科技发展有限公司;恒温培养振荡器,上海智城分析仪器制造有限公司;HT300A型自动固相微萃取仪,意大利HTA公司; 7890A- 5975B型气相色谱- 质谱联用仪,美国安捷伦公司。
1.3.1发酵基的配制
大米糖化液的制备:称取500 g大米粉末于适当的容器中加入3 500 mL水,蒸煮20 min后放凉至50 ℃并调节pH值为4.8~5.4;加入淀粉酶(每克干物质96个酶活力单位),50 ℃水浴液化30 min,液化完成后调节pH值为4.0~4.5;加入糖化酶216 U/(g干物质),60 ℃,糖化35 h后煮沸灭酶,冷却至室温后4 000 r/min,离心3 min,收集上清液备用[9-10]。
麸皮浸提液制备:称取100 g麸皮于适当容器中加入500 mL水,蒸煮10 min后放凉至50 ℃并调节pH值为4.8~5.4,加入淀粉酶1 500 U/(g干物质),50 ℃水浴10 min,完成后调节pH值至中性;加入中性蛋白酶50 000 U/(g干物质),55 ℃水浴30 min,过滤后取滤液煮沸灭酶,冷却至室温后4 000r/min,离心3 min,收集上清液备用[11]。按照大米糖化液与麸皮浸提液之比为7∶3(体积比),制备发酵培养基。
1.3.2曲药中酵母菌的分离纯化
将曲药用研钵研磨后称取10 g至100 mL无菌生理盐水,150 r/min、28 ℃下振荡30 min;取1 mL原液,依次进行10倍稀释,稀释至10-7倍;对10-5、10-6、10-7稀释倍数菌悬液进行平板涂布,涂布于YPD培养基和虎红琼脂培养基(在倒平板前应按照每100 mL培养基加入2%的脱氧胆酸钠溶液2 mL以抑制霉菌菌丝蔓延),每个稀释度做3个平行实验,28 ℃恒温培养48 h;挑取单菌落,在YPD平板上划线纯化,纯菌株移入斜面保藏备用。
1.3.3酵母菌的初步鉴定
观察并记录筛选的酵母菌菌落大小、形状、颜色、透明度、边缘、质地、湿润程度等菌落特征;取生理盐水1滴,滴于载玻片中央,用接种环挑取菌落少许,涂匀,加盖玻片,于40倍显微镜镜下观察细胞形态;观察记录菌体形状、大小、出芽情况、芽体形态、是否有裂殖现象等。
1.3.4酵母菌的18S rDNA分子鉴定
提取酵母菌总DNA[12],进行18S rDNA的PCR扩增,通用引物NL-1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL- 4(5′-GGTCCGTGTTTCAAGACGG- 3′)。PCR反应体系(50 uL)为:无菌超纯水33.5 μL,Buffer 5 μL,dNTP 4 μL,Mg2+3 μL,两个引物各1 μL(10 mol/L),模板2 μL,Taq聚合酶0.5 μL。PCR反应条件:94 ℃预变性5 min,94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸90 s,共35个循环,最后72 ℃延伸10 min;通过140 V电泳20 min检测结果。将测得的序列在GenBank 核酸数据库进行Blast比对,并将获得的同源序列和测定序列在Clustalx软件包中进行分析,形成一个多重序列匹配排列阵。通过MEGA软件构建系统发育树。
1.3.5酵母菌生长特性实验
探究不同浓度的pH值、碳源、氮源、酒精度的发酵条件对酵母菌生长的影响。将发酵培养基pH值分别调节为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0,以5%接种量接入目的菌株,于28 ℃培养24 h后,测定不同pH值下的发酵液OD600值;以淀粉、葡萄糖、蔗糖、麦芽糖、乳糖为碳源,分别加入无碳源基础培养基中,以5%接种量接入目的菌株,于28 ℃培养24 h后,测定不同碳源的发酵液OD600值;以尿素、酵母膏、蛋白胨、硫酸铵作为氮源,分别加入无氮源基础培养基中,以5%接种量接入目的菌株,于28 ℃培养24 h后,测定不同氮源的发酵液OD600值。在灭菌后的YPD液体培养基中,将酒精浓度分别调节为0%、2%、4%、6%、8%、10%,以5%接种量接入目的菌株,于28 ℃培养24 h后,测定不同酒精浓度的发酵液OD600值。
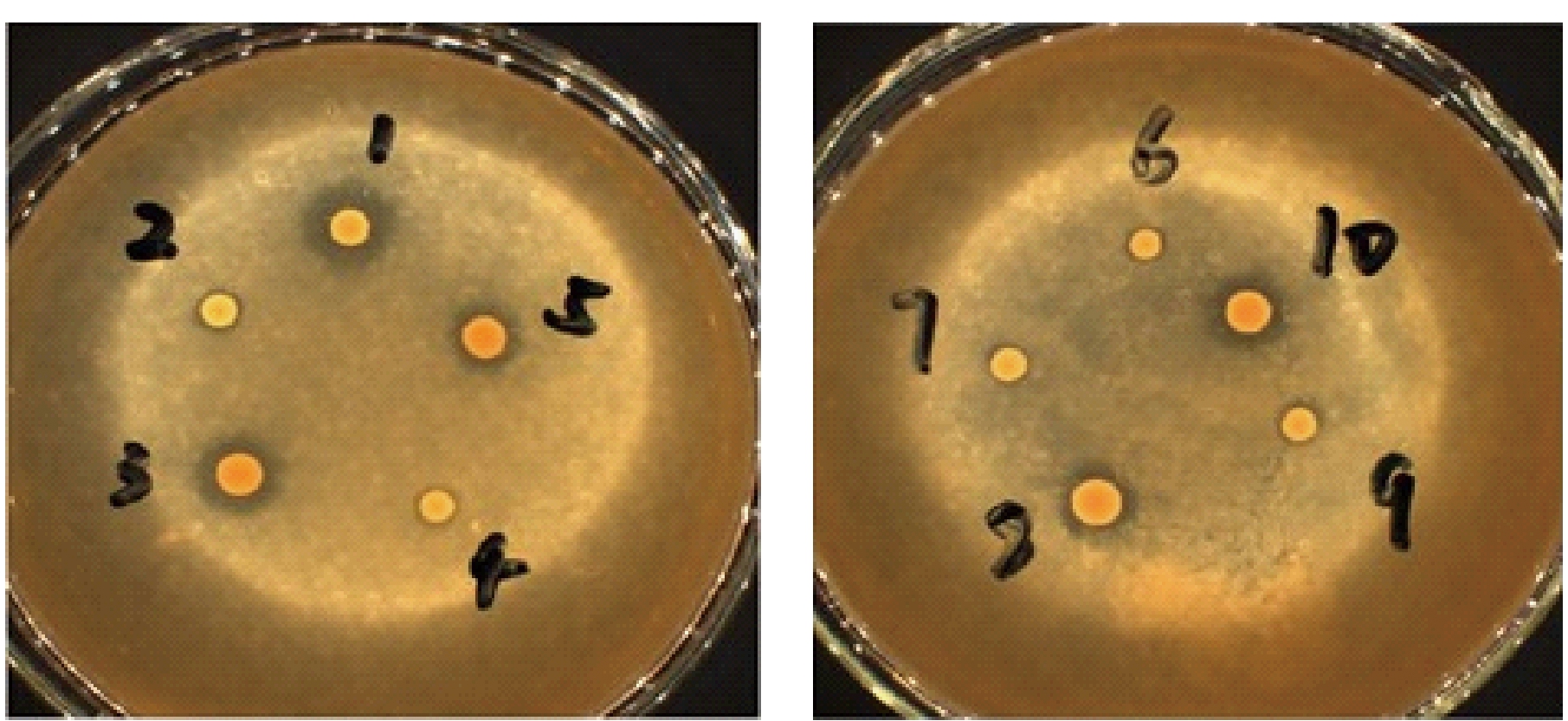
图1 初筛平板产酯透明圈图
Fig.1 Transparent zone of ester production of initial screening plate
1.3.6发酵代谢产物中挥发性成分的定量测定
样品前处理:吸取6 mL空白液和发酵液放入15 mL的顶空瓶中,加入1.5 g氯化钠,20 μL标品;在60 ℃萃取40 min,并230 ℃解吸3 min。GC-MS条件参数:色谱条件为DB-FFAP弹性石英毛细管柱,柱长30 mm,内径0.25 mm,液膜厚度0.25 μm,载气为氦气,流量1.0 mL/min,不分流,进样口温度230 ℃;柱温为起始温度35 ℃,以5 ℃/min 的速度升至180 ℃,再以10 ℃/min 的速度升至230 ℃,保持5 min。质谱条件为电离电压70 eV,离子源温度230 ℃,四极杆温度150 ℃,电离方式EI,质量扫描范围20~500 amu,溶剂延迟3 min。数据分析:检出挥发性物质的质谱图,通过与标准谱库(NIST05a.L)对比鉴定,匹配度和纯度大于800作为鉴定结果[13]。以乙酸丁酯为内标,按峰面积归一化法算出样品中各组分的相对含量[14]。
通过稀释涂布和平板划线,从曲药中分离出10株酵母菌,分别编号Y1至Y10。Y1、Y2、Y3、Y8、Y10为第一类:菌落为乳白色、较湿润、边缘整齐、表面干燥、隆起圆整;Y4、Y5、Y7、Y9为第一类:菌落为白色、湿润、边缘整齐,表面光滑,隆起圆整;第三类是Y6,菌落为乳白色、湿润、边缘整齐、表面光滑、隆起圆整。形态特征的分类:第一类呈椭圆状,第二类呈椭圆状,第三类呈圆形;三类酵母菌均为芽殖。
将Y1至Y10酵母菌株点种到产酯平板筛选培养基上得到图1,测量并计算透明圈直径D和菌落直径d之比得到表1。从表1中可看出菌株Y1的D/d最大,故选择Y1作为后续实验菌株。
表1 酵母菌株Y1-Y10产酯透明圈结果
Tab.1 Transparent zone of ester production of yeast Y1-Y10
对酵母菌株Y1提取总DNA,并进行18S rDNA的PCR扩增,得到的扩增电泳结果如图2。由图2可以看出,PCR电泳图条带单一,清晰且明亮,无拖尾、无弥散现象、无二聚体条带;扩增出来的18S rDNA条带大小为750~1 000 bp,与目标长度一致,可以将PCR产物被送至测序公司测序。将测序结果在NCBI上进行Blast比对,获得同源性高的序列,并构建系统发育进化树,如图3。鉴定酵母菌Y1为异常威克汉姆酵母菌亚种,命名为Wicherhamomycessp.Lzcq 2014。
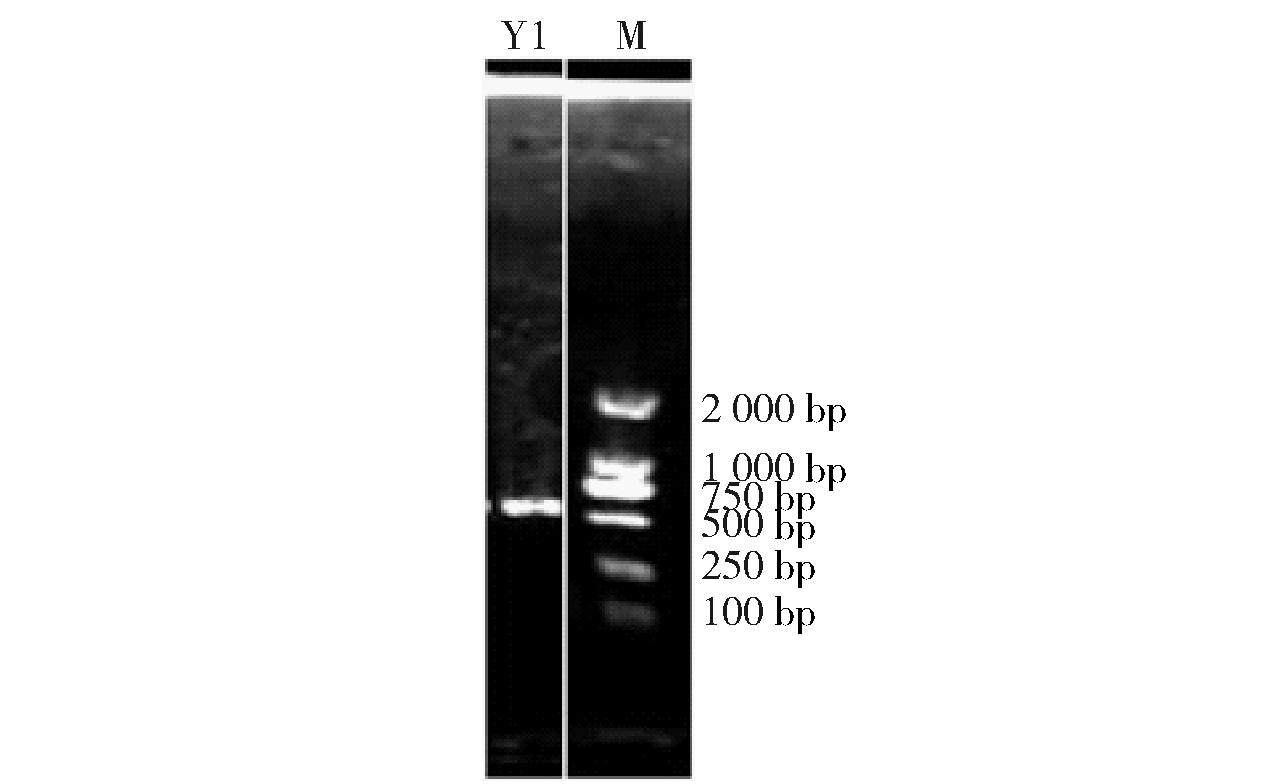
图2 酵母Y1 18S rDNA PCR扩增电泳图
Fig.2 Amplified electrophoretic profile of 18S rDNA regions of yeast Y1
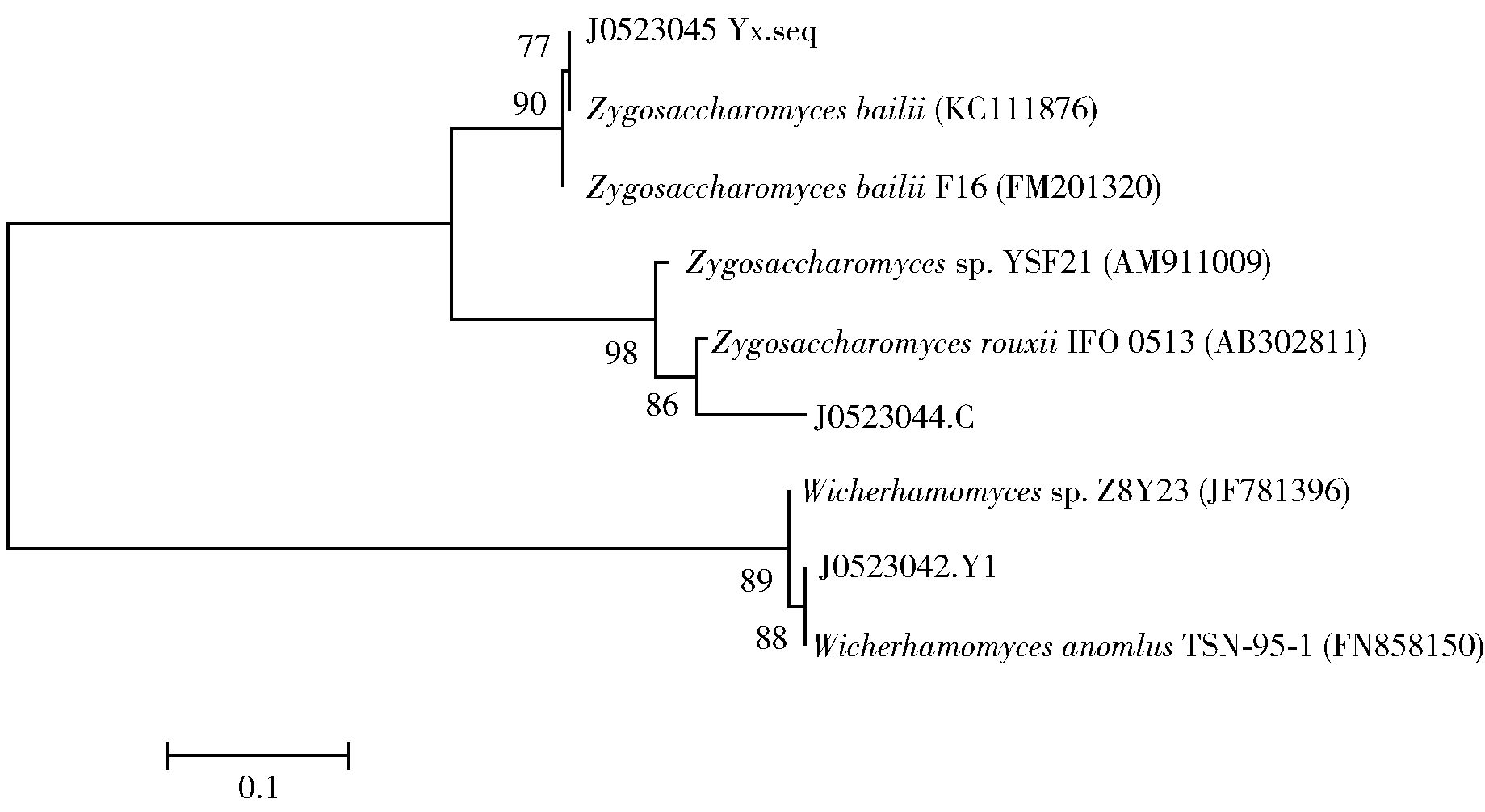
图3 酵母菌Y1的系统发育进化树
Fig.3 Phylogenetic tree of yeast Y1
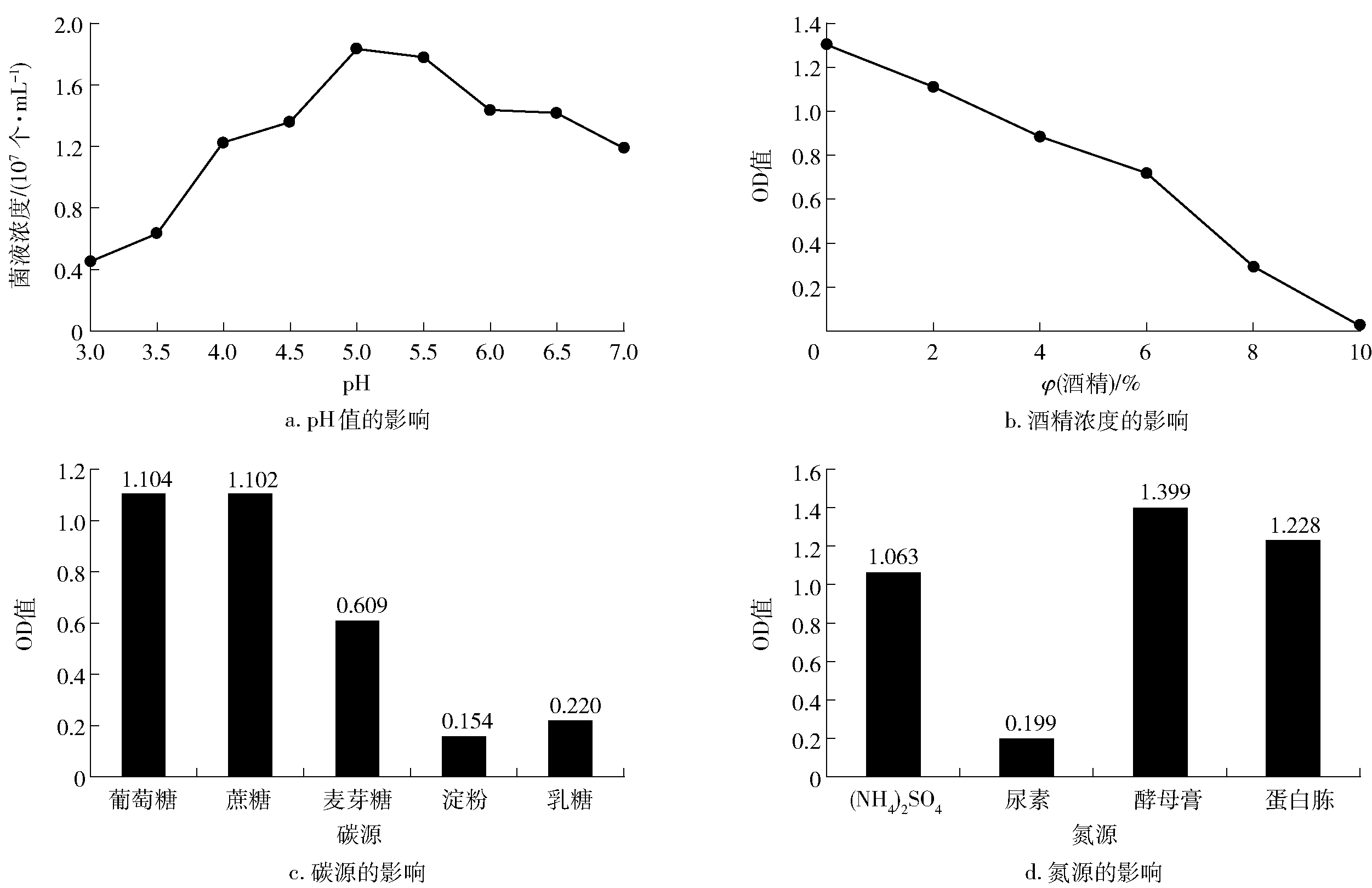
图4 不同pH、酒精浓度、碳源、氮源对Wicherhamomyces sp. Lzcq 2014生长量的影响
Fig.4 Effects of different pH values, alcohol concentrations, carbon sources, and nitrogen sources on mass growth of Lzcq 2014
不同初始pH值、酒精浓度、碳源、氮源下培养24 h后的发酵液酵母生长情况如图4。通常,微生物在pH值为3.0~9.0的环境中正常生长,超出这个范围则容易死亡。当微生物处于强酸环境中,因细胞膜的质子“泵”失去平衡而不能调节体内外的质子浓度差,从而导致细胞死亡。实验结果表明,酵母菌Wicherhamomycessp.Lzcq 2014菌株的最适生长pH值为5.0~5.5,其适合在偏弱酸性的环境生长。目前,酵母的酒精耐受机理还未完全清楚,温度和渗透压等因素均与酵母的酒精耐性有关[15]。Wicherhamomycessp.Lzcq 2014菌株在发酵代谢的时候,会产生酒精。产酯酵母对乙醇的亲和力较好,当有一定浓度乙醇存在时,更有利于酯类物质的产生。实验结果表明,Wicherhamomycessp. Lzcq 2014菌株的生长量随着酒精度的增大而变小,呈一定的反相关关系,且在酒精度为10%时,生长量几乎为零,说明该酵母不适宜在有一定酒精浓度的环境中生长。酵母的生长繁殖需要一定的碳源和氮源,不同碳源、氮源的分子结构不一样,微生物对其利用生长状况也会不一样。刘晓明等[16]研究了酵母对不同碳源(玉米粉、麸皮、豆面、葡萄糖)的利用效果,结果表明玉米粉对酵母发酵为较佳碳源。本实验结果表明,Wicherhamomycessp. Lzcq 2014对不同单一碳源的同化能力的强弱。顺序依次是葡萄糖、蔗糖、麦芽糖、乳糖、淀粉,Wicherhamomycessp. Lzcq 2014对不同氮源的同化能力的强弱顺序依次是酵母膏、蛋白胨、硫酸铵、尿素。
采用HS-SPME-GC-MS技术,对空白培养基和Wicherhamomycessp. Lzcq 2014发酵液的挥发性成分进行检测,结果见表2、表3。由表2、表3可以看出,发酵液中主要的成分是乙酸乙酯、甲酸异戊酯、丙酸苯乙酯和苯乙醇等,且乙酸乙酯浓度远高于其他化合物,其质量浓度为0.641 mg/L,说明这是一株高产乙酸乙酯的酵母菌株;其他化合物的含量相对较少。丙酸苯乙酯的含量变化可能是由于酵母菌在生长过程中分解了部分丙酸苯乙酯。2,4-二叔丁基苯酚和环己醇在发酵液中未检出,说明已被分解或转化成其他化合物。只在发酵液中检出甲酸异戊酯,说明此化合物是新生成的。
表2 空白培养基挥发性成分
Tab.2 Volatile flavor components of medium

表3 酵母Y1发酵代谢挥发性成分
Tab.3 Volatile flavor components of fermentation metabolites of yeast Y1

本实验从麸醋曲药中分离出10株酵母菌,分别编号为Y1至Y10,通过产酯平板筛选培养基得出Y1为这10株菌中产酯最好的一株,因此将Y1作为实验菌株。通过18S rDNA分子鉴定和构建酵母菌Y1的系统发育进化树确定酵母菌Y1为异常威克汉姆酵母菌亚种(命名为Wicherhamomycessp.Lzcq 2014)。Wicherhamomycessp. Lzcq2014的最适合生长pH值在5.0~5.5,其耐酒精的能力相对较弱,在酒精度为10%的情况下几乎不再生长;对不同碳源的同化能力的强弱顺序依次是葡萄糖、蔗糖、麦芽糖、乳糖、淀粉;对不同氮源的同化能力的强弱顺序依次是酵母膏、蛋白胨、硫酸铵、尿素。通过HS-SPME-GC-MS技术分析发酵液的挥发性风味成分,得出发酵液中主要成分是乙酸乙酯,其质量浓度为0.640 79 mg/L,远高于其他代谢产物。其他代谢产物分别为甲酸异戊酯、丙酸苯乙酯、苯乙醇,质量浓度分别为0.041 36、0.039 43、0.023 00 mg/L。
参考文献:
[1] 刘军,朱文优,杨勇.保宁醋固态发酵理化指标的动态分析[J].中国酿造, 2006, 158(5):45-47.
LIU J, ZHU W Y, YANG Y. Dynamic analysis of physiochemical index of Baoning vinegar with solid-state fermentation[J]. China Brewing, 2006, 158(5):45-47.
[2] 彭杨,张奶英,何利,等.基于PCR-DGGE技术的四川麸醋固态发酵过程中微生物群落分析[J].现代食品科技, 2016,32(8):171-177.
PENG Y, ZHANG N Y, HE L, et al. PCR-DGGE-based analysis of the microbial community in Sichuan bran vinegar during solid-state fermentation[J]. Modern Food Science and Technology, 2016,32(8):171-177.
[3] 缪杰,马惠香.四川麸醋的功能性[J].江苏调味副食品,2005, 94(4):38-39.
MIAO J, MA H X. The function of Sichuan grain vinegar[J]. Jiangsu Condiment and Subsidiary Food, 2005, 94(4):38-39.
[4] 张奶英,刘书亮,杨勇,等.四川麸醋发酵过程中理化指标与微生物菌相的动态分析[J].食品工业科技, 2014,35(11):174-178.
ZHANG N Y, LIU S L, YANG Y, et al. Dynamic analysis of physiochemical indexes and microbes in fermentation process of Sichuan bran vinegar[J]. Science and Technology of Food Industry, 2014,35(11):174-178.
[5] 于华,黄丹,陈卓,等.四川麸醋醋醅中产酸芽孢杆菌的分离及发酵特性研究[J].中国食品添加剂,2017(1):83-90.
YU H, HUANG D, CHEN Z, et al. Study on isolation of acid-producing bacillus from Sichuan bran vinegar and its fermentation characteristics[J]. China Food Additives, 2017(1):83-90.
[6] 周荣清.四川麸醋生产工艺的特点及发展趋势[J].四川食品与发酵,2000(3):24-28.
ZHOU R Q. Characteristics and development trend of Sichuan bran vinegar production technology[J]. Sichuan Food and Fermentation, 2000(3):24-28.
[7] 韩志双,刘军,黄思敏,等.传统麸醋醋醅中一株产香酵母的筛选鉴定及生长特性研究[J].中国调味品,2013,38(10):41-45.
HAN Z S, LIU J, HUANG S M, et al. Solation and identification of aroma-producing yeast from traditional brewing mass of bran vinegar[J]. China Condiment, 2013,38(10):41-45.
[8] 郜希璐.白酒窖泥中酵母菌的分离鉴定及发酵特性研究[D].天津:天津大学,2009.
GAO X L. Isolation, identification and fermentation chrac-teristics of yeast from liquor cellar mud[D]. Tianjin: Tianjin University, 2009.
[9] 国家质量监督检验检疫总局. 大米蒸煮过程中米粒糊化时间的评价:GB/T 25226—2010[S].北京:中国标准出版社,2010.
[10] 赵克勤,蒋民权,邹祖然,等.味精生产中陈糖大米糖化工艺的研究[J].食品工业技术, 2008, 26(9):108-110.
ZHAO K Q, JIANG M Q, ZOU Z R, et al. Study on saccharification technology of aged sugar rice in monosodium glutamate production[J]. Science and Technology of Food Industry, 2008, 26(9):108-110.
[11] 曹敬华,方尚玲,陈茂彬,等.嗜热芽孢杆菌对美拉德反应的作用[J].酿酒, 2010,37(6):55-58.
CAO J H, FANG S L, CHEN M B, et al. The effect of thermophilic bacillus on Maillard reaction[J]. Liquor Making, 2010,37(6):55-58.
[12] 冯广达,陈美标,羊宋贞,等.用于PCR扩增的细菌DNA提取方法比较[J]. 华南农业大学学报,2013, 34(3):439-442.
FENG G D, CHEN M B, YANG S Z, et al. A compara-tive study on bacteria DNA extraction methods used for PCR amplification[J]. Journal of South China Agricultural University, 2013, 34(3):439-442.
[13] 熊越.四川麸醋发酵过程中风味物质的变化研究[D].重庆:西南大学,2011.
XIONG Y. Study on the variation of flavor substances in fermentation process of Sichuan bran vinegar[D]. Chongqing: Southwest University,2011.
[14] 夏玙,罗惠波,周平,等.热风干燥工艺对贮存期大曲挥发性物质的影响[J].食品与发酵工业,2018,44(6):126-132.
XIA Y, LUO H B, ZHOU P, et al. Effect of hot-air drying process on volatile compounds of daqu during storage[J]. Food and Fermentation Industries, 2018, 44(6):126-132.
[15] 王滨, 张国政, 路福平, 等. 酵母酒精耐性机制的研究进展[J]. 天津轻工业学院学报, 2001, 36(1):18-23.
WANG B, ZHANG G Z, LU F P, et al. Progress on the ethanol tolerance mechanism in yeast[J]. Journal of Tianjin University of Light Industry,2001, 36(1):18-23.
[16] 刘晓明, 崔波, 橝琮萍. BYH酵母固体发酵培养基的优化[J]. 山东食品发酵, 2013, 168(1):11-17.
LIU X M, CUI B, TAN C P. Optimization of the BYH yeast solid fermentation culture[J]. Shandong Food Fermentation, 2013, 168(1):11-17.
MAO Xiang1,2, XIA Yu1, ZHANG Yunzhao1, ZHU Min1, ZHANG Man1,HUANG Dan1, LUO Huibo1,2,*
(1.College of Bioengineering,Sichuan University of Science and Engineering,Zigong643000,China;2.Laboratory of Biological Brewing Technology and Engineering of Bran Vinegar in South of Sichuan,Zigong643000,China)
Abstract:The yeast with strong ability producing ester was isolated by biochemical reactions in plate from Sichuan bran vinegar starter and identified by 18S rDNA homology analysis. The growth characteristics such as optimal growth pH, alcohol tolerance, assimilation capacity to carbon sources, and nitrogen sources were studied. And metabolites were studied by solid phase microextraction plus GC-MS techniques. The result showed that the yeast isolated from ester transparent ring experiment wasWicherhamomycessp. Lzcq 2014. The optimal growth pH was about 5.0 to 5.5, and it didn’t grow when the alcohol content was 10%. Meanwhile, the ability assimilating carbon source in desending order was glucose, sucrose, maltose, lactose, and starch, and the ability assimilating nitrogen source was yeast extract, peptone, ammonium sulfate, and urea. The main metabolite was ethyl acetate, and the concentration reached 0.640 79 mg/L. The contents of isoamyl formate, propanoic acid, and phenylethyl alcohol, were 0.041 36, 0.039 43, 0.023 00 mg/L, respectively.
Keywords:Sichuan bran vinegar starter; yeast; growth characteristics; fermentation characteristics; volatile flavor components
(责任编辑:叶红波)